МЕХАНИЗМЫ ДЕЙСТВИЯ
ЭКСПЕРИМЕНТАЛЬНАЯ ОНКОЛОГИЯ, 1980, 2, № 1, стр. 60 – 63
Влияние проспидина
на синтез ДНК в клетках меланомы В-16, костного мозга и эпителия тонкого
кишечника у мышей
И. С. СОКОЛОВА,
Н. А. РЯБОКОНЬ, Л. Б. ГОРБАЧЕВА, В. А. ЧЕРНОВ
В онкологической практике при лечении ряда
злокачественных новообразований (рак гортани, опухоли носоглотки, ретинобластома,
рак кожи, кожные ретикулезы и др.) широко применяется оригинальный отечественный
препарат проспидин—дихлорид N,
N3
- ди (γ-хлор-β-оксипропил) –
N1,
N2
- диспиротрипиперазиния, который отличается от известных цитостатических
лекарственных средств незначительной токсичностью, большой терапевтической
широтой, отсутствием угнетающего действия на кроветворение [I]. Проспидин
впервые синтезирован и биологически изучен во Всесоюзном
научно-исследовательском химико-фармацевтическом институте им. С. Орджоникидзе
[2, 3]. Имеются сведения, что проспидин отличается от известных
противоопухолевых лекарственных средств, в частности из группы алкилирующих
агентов, по фармакологическим свойствам (например, по действию на иммуногенез
[4], фармакокинетику [5]) и влиянию на некоторые внутриклеточные процессы
(клеточный цикл, синтез ДНК, влияние на гликолиз и дыхание, растворимую АТФазу,
проницаемость плазматической мембраны опухолевых клеток и т. д.) [6—10].
Высказано предположение о своеобразном мембранном механизме действия препарата
на опухолевую клетку, согласно которому ведущая роль в нарушении внутриклеточных
процессов принадлежит изменениям в плазматической мембране, вызываемым
проспидином [10].
С целью выявления отличий проспидина от других
противоопухолевых лекарственных средств в действии на внутриклеточные процессы
представляло интерес изучение "его влияния на синтез ДНК в опухолевых и
нормальных клетках. Важность и целесообразность проведения подобного
исследования определяется еще и тем, что для противоопухолевых препаратов
различных классов установлена положительная корреляция между их терапевтической
эффективностью и продолжительностью ингибирования синтеза ДНК в опухолевых
клетках [11—16].
В настоящей работе изучали влияние проспидина на
синтез ДНК в клетках меланозы В-16, а также в нормальных делящихся клетках
эпителия тонкого кишечника и костного мозга мышей. Опыты проводили на
мышах-гибридах С57В1/6ХСВА/2 массой до 20 г интактных (без опухоли) и с
подкожно перевитой меланомой В-16. Выбор меланомы В-16 для эксперимента
обусловлен ее достаточно высокой чувствительностью к проспидину. Проспидин
вводили внутрибрюшинно однократно в переносимой дозе 800 мг/кг на 12-е сутки
после прививки опухоли. Проспидин растворяли в физиологическом растворе. О
синтезе ДНК судили по включению 2-14С-тимидина, который вводили по
2мкКи на 1 мышь (удельная активность 50 мкКи/ммоль). Опыты начинали в 10 ч утра.
Через 1 ч после введения меченого предшественника и через 6, 12, 24, 48, 72 и 96
ч после введения проспидина мышей убивали. Дальнейшую обработку проводили по
методике, описанной ранее [15].
На рис. 1 представлены результаты изучения изменений
включения 2-14С-тимидина в ДНК клеток меланомы В-16 в зависимости от
времени экспозиции животных с проспидином. Установлено, что под влиянием
проспидина уже через 6 ч включение 2-14С-тимидина в ДНК опухолевых
клеток уменьшается приблизительно на 50%, в течение последующих 4-х суток синтез
ДНК остается на том же уровне.
В специальных опытах показано, что в течение суток
синтез ДНК в опухолевых клетках не изменяется (таблица). Наблюдаемое через 12 ч
после воздействия препарата незначительное восстановление включения 2-14С-тимидина
(рис. 1) не связано с изменениями синтеза ДНК, обусловленными суточным ритмом.
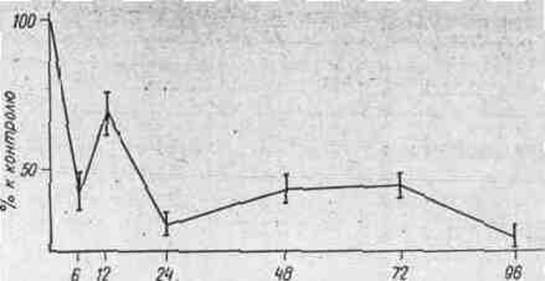
время, ч
Рис. 1. Включение 2-14С-тимидина
в ДНК меланомы В-16.
На рис. 2 представлены кинетические кривые изменения
включения меченого предшественника в ДНК костного мозга после введения
проспидина у интактных мышей и у мышей с меланомой В-16 (рис. 2). В течение
первых суток после введения препарата синтез ДНК в этих клетках у мышей с
меланомой В-16 не изменяется, затем начинается постепенное уменьшение включения
2-14С-тимидина в ДНК, которое к 4-м суткам достигает 50%. В отличие
от животных с опухолью у интактных мышей через 6 ч после введения препарата
синтез ДНК ингибируется на 50% (рис. 2 и 3, кривые 1, 2). Полученные
результаты подтверждают данные [17] о большей чувствительности хромосомного
аппарата опухолевой клетки по сравнению с клетками костного мозга к действию
проспидина.

Время, ч
Рис. 2.
Включение 2-14С-тимидина в ДНК костного мозга:
1 — здоровые
мыши; 2 — мыши с меланомой В-16.
Проспидин через 12 ч после введения иигибирует синтез
ДНК в клетках эпителия тонкого кишечника на 50% у животных обеих групп (рис. 3).
К 24-м ч после введения препарата отмечается плавное восстановление синтеза ДНК
в этих клетках, которое через 72 ч полностью заканчивается, а к 96 ч повторно
ингибируется на 50%. Следует отметить, что действие проспидина на включение 2-14С-тимидина
в ДНК клеток костного мозга и эпителия тонкого кишечника у здоровых мышей
выражено несколько сильнее (рис. 2 и 3, кривая 1).

Время, ч
Рис. 3.
Включение 2-14С-тимидина в ДНК эпителия тонкого кишечника:
1 — здоровые
мыши; 2 — мыши с меланомой В-16.
В отличие от клеток меланомы В-16 и костного мозга
синтез ДНК в эпителии тонкого кишечника активируется в дневные и вечерние часы
(таблица). Через 12 ч после введения проспидина (21 ч) наблюдается максимальное
ингибирование синтеза ДНК (рис.3), которое, вероятно, выражено еще значительнее,
если иметь в виду, что в это время суток у контрольных животных включение
меченого предшественника в клетки эпителия тонкого кишечника существенно
активировано (таблица).
Изменение включения 2-14С-тимидина в
ДНК опухолевых и нормальных делящихся клетках в течение суток*
|
Группа животных |
Время суток, ч |
Меланома
В-16, имп/мин в
1 мг ДНК |
% к конт- ролю |
Костный мозг, имп/мин в 1 мг
ДНК |
% к конт- ролю |
Эпителий тонкого кишечника
имп/мин в 1 мг ДНК |
% к конт- ролю |
|
Интактные мыши |
10 |
- |
- |
25936±2735 |
100 |
39780±2879 |
100 |
|
15 |
- |
- |
25161±3968 |
100 |
115744±15103 |
290 |
|
21 |
- |
- |
33426±4800 |
100 |
110000±13864 |
277 |
|
Мыши с меланомой В-16 (12-е
сут развив-шейся опухоли) |
10 |
18445±1560 |
100 |
31314±3560 |
100 |
47591±4138 |
100 |
|
15 |
18472±1285 |
100 |
26049±1985 |
100 |
54225±3550 |
100 |
|
21 |
19219±2150 |
100 |
28303±2350 |
100 |
84285± 10230 |
177 |
* Полученные результаты
воспроизведены в трех опытах.
Таким образом, проспидин, как и изученные ранее 1 -
(2-хлорэтил) -3- (2,6-диоксо-З-пиперидил)-1-нитрозомочевина и хлорозотоцин,
вызывает длительное, хотя и менее выраженное торможение включения 2-14С-тимидина
в ДНК клеток меланомы В-16, что удовлетворительно коррелирует с
противоопухолевой активностью этих препаратов, установленной в опытах на мышах с
меланомой В-16 [15].
Характер изменений синтеза ДНК под влиянием проспидина
и производных нитрозомочевины в клетках эпителия тонкого кишечника и особенно
костного мозга заметно различается [11, 12, 15].
N-алкил-N-нитрозомочевины
уже через 6 ч после введения максимально ингибируют синтез ДНК в нормальных
делящихся клетках. Проспидин в клетках костного мозга у мышей с меланомой В-16
начинает тормозить синтез ДНК только через сутки после введения препарата, затем
ингибирующий эффект медленно нарастает и к 96 ч достигает 50 % (рис. 2, 2).
Однако наблюдаемый эффект не следует полностью относить за счет действия
проспидина, так как нами в специальных опытах показано, что в процессе роста
меланомы В-16 синтез ДНК в клетках костного мозга постепенно снижается. Подобное
уменьшение синтеза ДНК в клетках костного мозга отмечено в процессе развития
лейкоза Р-388 у мышей [18]. Кроме того, не исключена возможность, что в процессе
роста меланомы В-16 в опухолевых клетках происходят дегенеративные изменения,
приводящие к потере способности синтезировать ДНК. Это явление отмечено для
клеток саркомы 45 [9].
Необычный характер воздействия проспидина проявляется
в полном отсутствии активи-рующего действия на синтез ДНК в опухолевых и
нормальных делящихся клетках, которое обычно наблюдается после восстановления от
повреждений, вызываемых антиметаболитами и алкилирующими агентами [11 — 15].
Причины стимуляции синтеза ДНК неясны. Предполагается, что этот эффект может
быть обусловлен переходом покоящихся клеток в состояние активной пролиферации
удалением популяции неделящихся клеток или уменьшением пула эндогенного
тимидинфосфата или его предшественников.
Молекулярные механизмы действия проспидина на аппарат
синтеза ДНК неизвестны. Мы предполагаем, что проспидин нарушает матричную
активность хроматина и ДНК, так как имеются сведения о том, что этот препарат
оказывает угнетающее действие на РНК-синтезирующую способность ДНК в гигантской
петле хромосом ооцитов гребенчатых тритонов [17]. Возможно также ингибирующее
действие проспидина на ферменты ДНК-полимеразы или состояние пула
низкомолекулярных предшественников синтеза ДНК. Учитывая стабилизирующее
влияние проспидина на плазматическую мембрану опухолевой клетки, приводящее к
изменению ее ионного гомеостаза [8], можно предположить, что уменьшение
включения 2-14С-тимидина в ДНК является следствием затрудненного
прохождения предшественника через мембрану. Примененный нами метод не исключает
также того, что уменьшение включения предшественника в ДНК является результатом
возникновения под влиянием проспидина клеток с явлениями дегенерации,
содержащих, но не способных синтезировать ДНК. Возможно, именно этим
обстоятельством следует объяснить расхождение наших данных с результатами опытов
на крысах с саркомой 45, в которых с помощью гистоаутодиографического метода не
обнаружено существенного уменьшения включения 3Н-тимидина в ДНК
опухолевых клеток в течение 48 ч после введения проспидина [7].
Литература
1. Проспидин—новое противоопухолевое средство/под ред. В. А.
Чернова.—Сб. трудов ВНИХФИ, вып. 3, М., 1973—271 с.
2. Соркина Ю. А.. Чернов В. А., Грушина А. А., Храмченкова
С. П. О противоопухолевой активности проспидина.—Вопр. онкологии, 1970, 16, № 7,
с. 83—86.
3. Михалев В. А., Чернов В. А., Дорохова М. И., Смолина Н.
Е., Тихонова О. Я. Галоидалкиламины и продукты их превращений. III. Спиразидин,
проспидин и некоторые другие производные
N’,N’’-
диспиротрипиперазиния.—Химико-фармацевт. журн., 1972, 6, № 6, с. 9—14.
4. Филитис Л. Н., Першин Г. Н. Об иммунодепрессивной
активности проспидина.— Фармакология и токсикология, 1977, 40, № 1, с. 89—92.
5. Чернов В. А; Богомолова Н. С., Минакова С. М., Сускова В.
С. Фармакокинетика проспидина у крыс.—В кн.: Фармакокинетика и метаболизм
лекарственных препаратов: Сб. трудов ВНИХФИ, вып. 7, М., 1978, с. 23—45.
6. Фактор В. М., Соколова А. С., Урываева И. В., Чернов В.
А., Бродский В. Я. Действие противоопухолевых препаратов дипина и проспидина на
клеточный цикл гепатоцитов регенерирующей печени мышей. — Химико-фармацевт.
журн., 1976, 16, № 10, с. 11—16.
7. Богомолова Н. С., Чернов В. А. Действие проспидина на
дыхание и гликолиз опухолевых клеток у мышей с асцитным раком Эрлиха.—В кн.:
Проспидин — новое противоопухолевое средство:Сб. трудов ВНИХФИ, вып. 3, М„,
1973, с. 74—77.
8. Преснова Ж. Ф; Чернов В. А. Влияние проспидина на
активность водорастворимой аденозинтрифосфатазы у крыс с саркомой 45.—В кн.:
Проспидин — новое противоопухолевое средство: Сб. трудов ВНИХФИ, вып. 3,
М., 1973, с. 78—80.
9. Ершова Ю. А., Минакова С. М., Чернов В. А., Лескова С. Г.
Влияние проспидина на включение 3Н-тимидина в ДНК саркомы 45 крыс.—В
кн.: Вопросы радиобиологии и биологического действия цитостатических препаратов,
Томск, 1977, с. 157 — 160.
10. Чернов В. А., Геодакян С. В. О роли плазматической
мембраны в механизме действия проспидина.— Химико-фармацевт. журн., 1976, 10, №
12, с. 7—13.
11. Uoung R. C. The
effect of methyl CCNU (NSO-95441) on the cellular kinetics of normal and
leukemic murine tissues in vivo.—Cell Tissue Kinet, 1973, 6, N 1, p. 35—49.
12. Wheeler G. P.,
Alexander J. A. Duration of inhibition of synthesis of DNA in tumours and host
tissues after single doses of nitrosoureas.—Cancer Res., 1974, 34, N 8, p.
1957—1964.
13. Uoung R. C.,
Goldbefg D., Sehein P. S. Enhanced antitumor effect of cytosine arabinoside
given in a schedule dictated by kinetic studies in vivo.— Biochem. Pharmacol,
1973, 22, N 2, p. 277—280.
14. Chabner B. A.,
Voung R. C. Threshold methotrexate concentration for in vivo inhibition of DNA
synthesis in normal and tumorous target tissues.—J. Clin.
Invest.,
1973, 52, N
8, p.
1804—1811.
15. Соколова И. С., Кукушкина Р. В., Горбачева Л. Б.
Различная чувствительность синтеза ДНК в нормальных и опухолевых клетках к
действию некоторых
N-алкил-N-нитрозомочевин.—Докл.
АН СССР, 1979, 245, № 1, с. 260—264.
16. Wheeler C. P.,
Alexander I. A. Rate of DNA synthesisas an indication of drug toxixity as a
quide for sche-
duling cancer
therapy.—Cancer Treat. Rep.,
1978, 62, N
5, p.
755—769.
17. Ершова Ю. А., Макаров В. Б., Чернов В. А., Сафронов В. В.
Цитогенетическое действие проспидина. — Химико-фармацевт. журн., 1977, 11, № 12,
с. 14—18.
18. Vesair D. W.,
McNUf S.. Tobias J., Wodinsky L. Importance of schedule in adriamycin
cyclophosphamide combination chemotherapy.—Eur. J. Cancer, 1978, 14, N 2, p.
141—146.
S. Sokolova, N.
A. Ryabokon, L. B. Gorbacheva, V. A. Chernov
PROSPIDINE EFFECT ON
THE DNA SYNTHESIS IN CELLS OF B-16 MELANOMA, BONE MARROW AND GASTROINTESTINAL
MUCOSA IN MICE
Summary
The DNA synthesis in the bone marrow and gastrointestinal (GI) mucosa of normal
and tumour-bearing mice aswell as in the B-16 melanoma was studied as affected
by prospidine [N, N3-di (γ-chloro-β-oxypropy)-N'N2-dispirotripiperasinium
dichloride]. The inhibition of the DNA - synthesis in melanoma cells, bone
marrow and GI mucosa was observed in various periods after the drug
administration. Kinetics of the inhibition and recovery of the DNA synthesis in
normal and tumour cells induced by prospidine was different from that of other
antitumour drugs (alkylating agents, nitrosoureas, antimetabolites).
|
