Саркома Капоши у больных
после трансплантации почки
(опыт одного центра)
(реферат)
А.В. Ватазин, В.А. Молочков, И.А. Казанцева, Е.О. Щербакова, Е.И.
Прокопенко, С.А. Пасов, С.Ю. Гулимова, А.В. Молочков, А.Н. Хлебникова
Московский областной научно-исследовательский клинический институт
им. М.Ф. Владимирского, Москва
Адрес для переписки: 129110, Москва, ул. Щепкина,
61/2, МОНИКИ им. М.Ф. Владимирского, отделение хронического гемодиализа
и трансплантации почки
Телефоны: (495) 284-57-91, 284-56-86, 284-54-53. Щербакова
Евгения Оттовна
Обобщен опыт многолетнего наблюдения 718 реципиентов
почечных трансплантатов (461 мужчин и 257 женщин, в возрасте от 18 до 63
лет), оперированных в отделении хронического гемодиализа и трансплантации
почки МОНИКИ за период с 1983 по 1998 гг. Длительность наблюдения составила
в среднем 41,3 мес. Среди злокачественных опухолей, диагностированных за
15-летний период, саркома Капоши (СК) констатирована в 15 случаях. Она
оказалась наиболее частой злокачественной опухолью после трансплантации
почки (ТП). Проанализированы сроки ее возникновения, клинические особенности
и исход заболевания. Достоверной зависимости частоты развития СК от дозы
циклоспорина А обнаружить не удалось. Приведены 2 клинических наблюдения:
тяжелое течение СК с множественным поражением внутренних органов и случай
регрессирования опухоли после снижения доз иммуносупрессии. Подчеркнута
важность ранней гистологической диагностики СК.
В 1872 г. М. Капоши впервые выделил в самостоятельную нозологическую
форму и описал пять случаев заболевания, которому дал название «идиопатическая
множественная пигментная саркома кожи» [2]. В настоящее время саркома Капоши
(СК) в соответствии с классификацией ВОЗ (1980) отнесена к злокачественным
опухолям кровеносных сосудов. В Гистологической классификации опухолей
мягких тканей 2 пересмотра [30] она занимает место в разделе злокачественных
эндотелиальных опухолей кровеносных и лимфатических сосудов. Общеизвестно,
что СК наиболее часто обнаруживается у больных СПИДом. Нередко опухоль
развивается и у больных, получающих иммуносупрессивную терапию и чаще всего
после трансплантации органов [25,28].
Выделяют 4 клинических типа саркомы Капоши [2,14]:
1. классический (идиопатический);
2. африканский (эндемический);
3. СПИД-ассоциированный (эпидемический);
4. иммуносупрессивный (иммунозависимый).
К развитию СК имеют прямое отношение этиологические факторы, ассоциированные
с иммуносупрессией, прежде всего вирусы [1,24]. Начиная с семидесятых годов,
этиологию этого заболевания связывали с различными вирусами: Эпштейн-Барра
(ЭБВ), цитомегаловирусом (ЦМВ) и его ассоциацией с вирусами Herpes simplex
первого и второго типа, а также с вирусом T-клеточного лейкоза человека
[2]. Однако в 1994 г. группа зарубежных авторов сообщила о выявлении с
помощью полимеразной цепной реакции (ПЦР) ДНК нового герпес-вируса человека
- 8 типа (HHV-8) у больных с различными типами СК [12,22]. Впоследствии
в ряде исследований эти данные были подтверждены и дополнены. Так ДНК-последовательности
HHV-8 обнаруживались у подавляющего большинства реципиентов ренальных трансплантатов
в кожных и висцеральных элементах СК [7,23], но не выявлялись в биоптатах
здоровой кожи и в тканях других опухолей [4,10,11]. Более того, если ДНК
вируса определялась в ткани СК в разгаре заболевания, то после достижения
ремиссии повторные биоптаты тех же участков кожи давали негативную ПЦР
[23].
В развитии СК могут играть роль генетические факторы. Показана связь
HLA DR5 как с классической, так и с ВИЧ-ассоциированной формой СК [13].
Среди реципиентов почечных трансплантатов с СК HLA A2 встречается достоверно
чаще, чем в контрольной популяции [27].
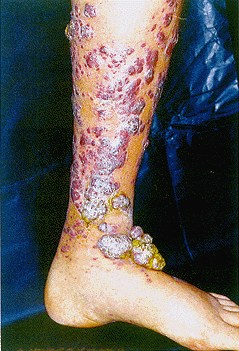
Элементы СК располагаются на коже (рис.1) и на слизистых оболочках в
виде розовых, красных, коричневых или пурпурных пятен, бляшек, узелков
или опухолей [2]. Ранние проявления обычно представляют собой бледные розовые
пятна или бляшки. В 30-50% случаев СК локализуется на голенях и стопах
и имеет симметричное распределение, типичное для классической формы СК
[16]. Очаги поражения могут располагаться также на верхних конечностях,
туловище, лице, реже на коже век, в области мошонки, ушных раковин, слизистой
языка, полового члена. Кроме кожи, наиболее часто, поражаются лимфатические
узлы, желудочно-кишечный тракт и дыхательные пути.
Рис.1. Саркома Капоши. Характерные опухолевидные темно-пурпуровые
образования на коже
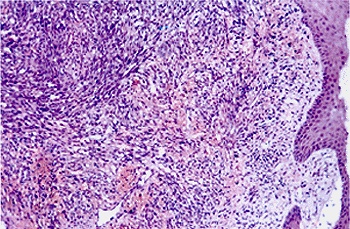
 Вне зависимости от клинического типа и локализации, гистологическая картина
СК характеризуется хаотичным несовершенным ангиогенезом с образованием
щелевидных сосудистых пространств, пролиферацией веретенообразных клеток
и инфильтрацией иммунокомпетентными клетками (рис.2). Клинический диагноз
СК не всегда прост: имитировать опухоль могут пурпура, гемангиомы, бациллярный
ангиоматоз, дерматофибромы, плоский лишай, pityriasis rosea, грибовидный
микоз, невусы, меланома, кожная лимфома, вторичный сифилис и генерализованная
прогрессирующая телеангиэктазия [17]. Морфологами СК иногда диагностируется
как лейомиома, гемангиома, веретеноклеточная меланома, фибросаркома, продуктивное
неспецифическое воспаление [1].
Вне зависимости от клинического типа и локализации, гистологическая картина
СК характеризуется хаотичным несовершенным ангиогенезом с образованием
щелевидных сосудистых пространств, пролиферацией веретенообразных клеток
и инфильтрацией иммунокомпетентными клетками (рис.2). Клинический диагноз
СК не всегда прост: имитировать опухоль могут пурпура, гемангиомы, бациллярный
ангиоматоз, дерматофибромы, плоский лишай, pityriasis rosea, грибовидный
микоз, невусы, меланома, кожная лимфома, вторичный сифилис и генерализованная
прогрессирующая телеангиэктазия [17]. Морфологами СК иногда диагностируется
как лейомиома, гемангиома, веретеноклеточная меланома, фибросаркома, продуктивное
неспецифическое воспаление [1].
Рис.2. Гистологический препарат кожного узла СК. Окр. гематоксилин
и эозин. Ув. 850. Хаотичный ангиогенез с образованием щелевидных сосудистых
пространств. Пролиферация веретенообразных клеток.
Частота СК после трансплантации почки (ТП) составляет от 0,4 до 5,3%
[18,27,28]. Риск ее развития у реципиентов в 150-1000 раз выше, чем в общей
популяции. Полагают что доза циклоспорина А (ЦсА) коррелирует с риском
возникновения СК [21]. В общей популяции СК возникает чаще у мужчин. При
иммуносупрессивной форме СК влияние пола несколько сглаживается. В частности
возрастает ее частота у женщин, так что отношение мужчины : женщины снижается
с 4 : 1 в общей популяции до 2 : 1 среди больных, получающих иммуносупрессию
[19]. Нередко (до 40% случаев) у реципиентов ренальных трансплантатов наблюдается
агрессивное течение СК с поражением лимфатических узлов и внутренних органов
[25]. Средние сроки развития опухоли после трансплантации почки составляют
от 6,5 до 21,1 мес. [18,27,28]. Особенностью иммуносупрессивного типа СК
является ее полная ремиссия у 24-84% больных при ослаблении или отмене
иммуносупрессии и рецидивирование опухоли при ее возобновлении [20,25,29].
Выраженные висцеральные поражения не исключают возможности полной ремиссии
[8].
Лечение СК является сложной задачей и зависит от конкретной клинической
ситуации. Как только что отмечено, отмена иммуносупрессии при иммуносупрессивном
типе СК достаточно эффективна, но нередко приводит к развитию отторжения
и потере функции трансплантированного органа [26]. Предпринимаются попытки
лечения больных СК, в том числе и реципиентов донорских органов, интроном-А
(интерфероном-a-2b) [9,15]. При угрожающем жизни прогрессировании СК применяются
цитостатики: винбластин, этопозид, блеомицин, винкристин, доксорубицин
[3,13]. Исследования отечественных авторов показали, что одним из самых
эффективных цитостатиков при СК является отечественный препарат проспидин
[2]. Разработана лимфотропная проспидинотерапия, позволяющая вдвое снизить
курсовую дозу препарата [5]. Иногда применяется полихимиотерапия [9] и
даже сочетание химио-, лучевой терапии и редукции иммуносупрессии [6].
Целью настоящего ретроспективного исследования был анализ особенностей
развития, клинического течения и исхода СК у реципиентов ренальных трансплантатов,
наблюдавшихся в нашем центре.
Клиническая характеристика и методы исследования
В отделении хронического гемодиализа и трансплантации почки (ОХГ и ТП)
МОНИКИ наблюдались 718 реципиентов почечных трансплантатов, оперированных
с января 1983 г. по август 1998 г. Во всех случаях была выполнена трансплантация
трупной почки (ТП). Срок функционирования трансплантата составил не менее
6 мес. Средний срок наблюдения после ТП был равен 41,3 мес. (диапазон от
6 до 193 мес.). Среди 718 пациентов мужчин было 461 (64,2%), женщин 257
(35,8%). Возраст больных колебался от 17 до 63 лет, составляя в среднем
36,3 ± 8,3 г. В послеоперационном периоде использовались различные схемы
иммуносупрессии: 76 больных получали азатиоприн (Аза) и преднизолон (П)
в суточной дозе 1,0 мг/кг; 262 пациента - ЦсА 10 мг/кг и выше (стартовая
доза) в сочетании с П 0,5 мг/кг; 216 - ЦсА 4-6 мг/кг, Аза и П 0,5 мг/кг;
164 - ЦсА 2,5-3 мг/кг с кетоконазолом 100 мг/сут, Аза и П 0,5 мг/кг. Кетоконазол
(ККз) применялся для повышения и стабилизации концентрации ЦсА в крови.
Кризы отторжения трансплантата лечили в/в введением метилпреднизолона в
виде пульс-терапии до общей дозы препарата 2,5-3 г. При стероидрезистентных
кризах применяли препараты антилимфоцитарных антител - поликлональных (АТГ
или антилимфолин) или моноклональных (OKT3).
Больные с изменениями кожи осматривались дерматологом. В обязательном
порядке проводилось стандартное клиническое обследование. Выполнялась биопсия
кожных поражений с гистологическим исследованием биоптатов. У всех пациентов
была исключена ВИЧ-инфекция с помощью определения антител методом иммуноферментного
анализа. Кроме того, образцы сывороток 47 реципиентов исследовались в реакции
непрямой иммунофлюоресценции (н-ИФ) на наличие антител к антигенам HHV-8.
Биоптаты доброкачественных эпителиальных опухолей кожи 6 больных и материал
СК, полученный у 1 реципиента, исследовались на наличие ДНК-последовательностей
HHV-8 в полимеразной цепной реакции (ПЦР) с праймерами KS330233.
Статистический анализ. Показатели, подчиняющиеся нормальному распределению,
были представлены в виде M ± SD (среднее значение ± стандартное отклонение).
Показатели с распределением, отличающимся от нормального, описывались при
помощи медианы и диапазона колебаний. При оценке достоверности различий
количественных признаков были использованы: двухвыборочные t-критерии Стьюдента
с одинаковыми и разными дисперсиями, однофакторный дисперсионный анализ
- для 3 и более выборок. Для оценки достоверности различий качественных
признаков использовался c2-критерий.
Результаты и обсуждение
За весь период наблюдения СК выявлена у 15 из 718 (2,09%) наблюдавшихся
больных. В нашем исследовании она оказалась наиболее часто встречающейся
опухолью: доля больных СК составила 45,4% от всех пациентов со злокачественными
новообразованиями (15 из 33). В табл.1 приведены клинические особенности
пациентов с развившейся СК.
Характеристика реципиентов с СК и сроки развития опухоли
| Б-е |
Пол |
Возр., лет |
Диагноз |
Фенотип |
Иммуно-
супрессия |
Время после начала ГД, мес. |
Время после ТП, мес. |
Др. осложнения |
| 1 |
ж |
55 |
ХГН |
A1,19 B12,13 DR6,7 |
3-комп.+ Ккз. |
29 |
23 |
Рак молочной железы |
| 2 |
м |
38 |
Амилоидоз |
A2,10 B7 |
3-комп.+ Ккз. |
49 |
43 |
ЦМВ-инфекция, Язва желудка, гепатит B, кератоакантома |
| 3 |
м |
51 |
ХГН |
A2 B15,27 |
ЦсА 10 + П 0,5 |
30 |
24 |
- |
| 4 |
ж |
43 |
ХГН |
- |
П 1,0 + Аза |
161 |
158 |
- |
| 5 |
ж |
41 |
ХГН |
A9,10 B47 DR7 |
3-комп.+ кет. |
50 |
5 |
- |
| 6 |
м |
49 |
Аномалия мочевой системы |
A1 B27,37 DR1,8 DQ2,3 |
3-комп. |
33 |
5 |
Гепатит B,C,D |
| 7 |
ж |
35 |
ХГН |
- |
ЦсА 10+ П 0,5 |
27 |
12 |
Урологические осложнения |
| 8 |
ж |
37 |
ХГН |
- |
3-комп. |
45 |
9 |
Стойкая мочевая инфекция |
| 9 |
м |
22 |
ХГН |
A2,10 B7,41 |
3-комп. |
23 |
18 |
- |
| 10 |
м |
44 |
ХГН |
A28,32 B18,35 |
3-комп. |
19 |
13 |
Урологические осложнения, токсический гепатит, стероидный
сахарный диабет |
| 11 |
м |
50 |
ХГН |
- |
ЦсА 10 + П 0,5 |
53 |
24 |
Стероидный сахарный диабет |
| 12 |
м |
39 |
ХГН |
- |
3-комп. |
32 |
31 |
Язва желудка |
| 13 |
м |
40 |
Поликистоз почек |
A1,2 B15,35 |
3-комп. |
57 |
29 |
Гепатит B, ЦМВ-инфекция |
| 14 |
м |
51 |
ХГН |
- |
3-комп. |
23 |
11 |
Пиелонефрит трансплантата |
| 15 |
ж |
43 |
ХГН |
- |
П 1,0 + Аза |
26 |
13 |
Мочевая инфекция, Herpes zoster, асептический некроз
головки бедра |
Из 15 больных у 14 была кожная форма СК, а у 1 реципиента - распространенный
процесс с множественным вовлечением внутренних органов. В 14 случаях были
поражены нижние конечности. В одном случае начало заболевания проявилось
поражением ушной раковины, вслед за чем очаги поражения появились на коже
туловища и нижних конечностей.
Среди больных СК было 9 (60%) мужчин и 6 (40%) женщин, что примерно
соответствует соотношению, описанному при иммуносупрессивном типе СК [19].
Средний возраст реципиентов с СК составил 42,5 ± 8,2 г. и был значимо выше
(p<0,01), чем возраст пациентов без опухолей - 36,1 ± 8,4 г.
СК относится к ранним посттрансплантационным опухолям. Медиана промежутка
времени от момента ТП до диагностики СК составила 18 мес. (5-158 мес.),
а от начала лечения гемодиализом (ГД) - 32 мес. (19-161 мес.).
Известна связь HLA DR5 и A2 с предрасположенностью к СК [13,27]. К
сожалению, антигены DR были определены только у 3 из наших больных, страдавших
СК. В их число вошел и больной с висцеральными поражениями. Ни у одного
из обследованных пациентов не было выявлено DR5. В то же время у 50% больных
СК, у которых фенотип был известен, имелся A2.
У 11 из 15 реципиентов, кроме СК, имелись и другие характерные для
посттрансплантационного периода осложнения, а именно, герпес-вирусные инфекции,
стойкая мочевая инфекция, язвенные поражения желудочно-кишечного тракта,
вирусный и токсический гепатиты, стероидный сахарный диабет. Заслуживает
внимания сочетание СК с другими опухолевыми процессами: со стойкой кератоакантомой
в одном случае, и раком молочной железы в другом.
Нам не удалось обнаружить связи между частотой развития СК у реципиентов
ренальных трансплантатов и дозой ЦсА (табл.2). Возможно, для выявления
такой зависимости необходимо увеличение числа наблюдений.
Таблица 2.
Распределение случаев СК в группах реципиентов, выделенных в
зависимости от суточной дозы ЦсА (в мг/кг массы тела)
| |
Без ЦсА |
ЦсА 2, 5-3 |
ЦсА 5-6 |
ЦсА 10 |
| Число больных СК |
2 |
3 |
7 |
3 |
| Общее число реципиентов |
76 |
164 |
216 |
262 |
| Доля заболевших |
2,63% |
1,83%
|
3,24%
|
1,14%
|
Один пациент с целью лечения СК получил курс проспидинотерапии в сочетании
с последующей редукцией иммуносупрессии. Пяти больным с нормальной функцией
трансплантата была снижена доза ЦсА или препарат был отменен; двум пациентам
иммуносупрессивная терапия была практически полностью отменена по причине
уже резко нарушенной почечной функции и возобновления гемодиализа; одному
пациенту произведено хирургическое иссечение узла СК; четыре реципиента
не получили лечения, так как после установления диагноза СК выбыли из-под
наблюдения; двум больным терапия не проводилась из-за тяжести состояния
в связи с сопутствующей патологией.
Из 15 больных СК к настоящему времени 6 выбыли из наблюдения; живы
2 пациента, из которых 1 - с функционирующим трансплантатом и 1 вернулся
на гемодиализ; умерло 7 реципиентов (5 - с функционирующим почечным трансплантатом,
2 - после возврата на гемодиализ). Причинами смерти больных были печеночная
недостаточность - в 2 случаях; раковая кахексия - в 1 случае (сочетание
СК и рака молочной железы); сепсис - в 1 случае; сердечно-сосудистая недостаточность
- в 3 случаях.
При выявлении антител к HHV-8 в реакции н-ИФ серопозитивными оказались
обе исследованные сыворотки реципиентов с СК. При изучении 45 сывороток
пациентов без СК антитела были обнаружены только у 6 больных без какой-либо
кожной патологии. Эти больные отнесены к группе повышенного риска развития
СК с целью интенсивного наблюдения. У 6 пациентов материал из доброкачественных
эпителиальных опухолей кожи (кератоакантома, папилломы, плоские и вульгарные
бородавки, себорейный кератоз) исследован методом ПЦР для выявления ДНК
HHV-8. Ни в одной из проб не было позитивной ПЦР. В то же время при исследовании
биоптата СК выявлены HHV-8-специфические последовательности ДНК.
У реципиентов почечных трансплантатов СК может иметь различное течение,
как относительно доброкачественное, так и быстро прогрессирующее, с поражением
внутренних органов и неблагоприятным прогнозом.
Заключение
СК является типичной «оппортунистической» опухолью у реципиентов почечных
трансплантатов: в нашем исследовании она была выявлена у 2,09% наблюдавшихся
больных и оказалась наиболее часто встречающейся злокачественной опухолью.
По нашим данным СК чаще всего поражает нижние конечности. Множественные
висцеральные проявления СК развились у одного из 15 реципиентов.
Достоверно чаще СК развивалась у больных старших возрастных групп.
Опухоль диагностировалась в среднем через 18 мес. после ТП, при этом сроки
выявления СК были вариабельными и колебались от 5 до 158 мес. Нам не удалось
выявить достоверной зависимости частоты развития СК от дозы ЦсА.
Важную роль в патогенезе СК играет недавно открытый вирус из семейства
герпес-вирусов HHV-8, однако особенности его участия в развитии СК у больных
после трансплантации почки требуют дальнейшего изучения.
Иммуносупрессивный тип СК, по-видимому, нельзя считать «безобидным»
заболеванием, приносящим лишь косметические неудобства. Прогноз СК у большинства
пациентов, получающих иммуносупрессию, при отсутствии лечения достаточно
серьезен, поэтому совершенно необходима ранняя диагностика опухоли. Все
подозрительные участки кожи должны подвергаться биопсии с последующим гистологическим
исследованием. В ряде случаев по витальным показаниям, несмотря на риск
потери трансплантированного органа, приходится значительно ослаблять или
даже отменять иммуносупрессию.
Литература
-
Казанцева И.А. Саркома Капоши: этиология, патогенез, гистогенез,
патоморфологическая диагностика. Российский журнал кожных и венерических
болезней. 1998; 1: 6-9.
-
Каламкарян А.А., Акимов В.Г., Казанцева И.А. Саркома Капоши. - Новосибирск:
Наука, 1986; 111.
-
Машкиллейсон А.Л. Лечение кожных и венерических болезней: Руководство
для врачей. М., 1990; 503-511.
-
Молочков А.В. Данные о связи саркомы Капоши с герпесвирусом человека
8-го типа (HHV-8) и разработка патогенетической терапии: Автореф. дис.
канд. мед. наук. М., 1999; 17 с.
-
Чилингиров Р.Х., Краснощекова Н.Ю., Молочков А.В. К проблеме совершенствования
терапии саркомы Капоши. Российский журнал кожных и венерических болезней.
1998; 1: 12-14.
-
Aebischer M.C., Zala L.B., Braathen L.R. Kaposi's sarcoma as manifestation
of immunosuppression in organ transplant recipients. Dermatology. 1997;
195; 1: 91-92.
-
Alkan S., Karcher D.S., Ortiz A. et al. Human herpesvirus-8/ Kaposi's
sarcoma-associated herpesvirus in organ transplant patients with immunosuppression.
Br. J. Haematol. 1997; 96; 2: 412-414.
-
Al-Sulaiman M.H., Mousa D.H., Dhar J.M., Al-Khader A.A. Does regressed
posttransplantation Kaposi's sarcoma recur following reintroduction of
immunosupression. Am. J. Nephrol. 1992; 12; 384-386.
-
Braun-Falco O. Dermatology. - London, 1991.
-
Cathomas G., Tamm M., McGandy C.E. et al. Absence of Kaposi's sarcoma-associated
human herpes virus 8 in transplantation-related tumors other than Kaposi's
sarcoma Transplant. Proc. 1997; 29; 836-837.
-
Cathomas G., Tamm M., McGandy C.E. et al. Transplantation-associated
malignancies: restriction of human herpes virus 8 to Kaposi's sarcoma.
Transplantation. 1997; 64; 1: 175-178.
-
Chang Y., Cesarman E., Pessin M.S. et al. Identification of herpes-like
DNA sequence in AIDS-associated Kaposi's sarcoma. Science. 1994; 266; 1865-1869.
-
Cockerell C.J., Friedman-Kien A.E. Cutaneous Oncology, Pathophysiology,
Diagnosis and Managment / Ed. S.I. Miller, M.E. Malony. - Malden, 1998;
873-886.
-
Dalgleish A.G. Kaposi's sarcoma Br. J. Cancer. 1991; 64; 3-6.
-
Halmos O., Inturri P., Galligioni A. et al. Two cases of Kaposi's
sarcoma in renal and liver transplant recipients treated with interferon.
Clin. Transplant. 1996; 10; 374-378.
-
Krigel R.L., Friedman-Kien A.E. Epidemic Kaposi's sarcoma Semin.
Oncol. 1990; 17; 350-360.
-
Lee E.S., Locker J., Nalesnik M. et al. The association of Epstein
Barr virus with smooth-muscle tumors occuring after organ transplantation.
N. Eng. J. Med. 1995; 332; 19-25.
-
Lesnoni La Parola I., Masini C., Nanni G. et al. Kaposi's sarcoma
in renal-transplant recipients: experience at the Catholic University in
Rome, 1988-1996 Dermatology. 1997; 194; 229- 233.
-
Martin R.W., Hood A.F., Farmer E.R. Kaposi's sarcoma Medicine. 1993;
72; 245-261.
-
Montagnino G., Bencini P., Tarantino A. et al. Clinical features
and course of Kaposi's sarcoma in kidney transplant patients: Report of
13 cases Am. J. Nephrol. 1994; 14; 121-126.
-
Montagnino G., Lorca E., Tarantino A. et al. Cancer incidence in
854 kidney transplant recipients from a single institution: comparison
with normal population and with patients under dialytic treatment Clin.
Transplant. 1996; 10; 461-469.
-
Moore P.S., Chang Y. Detection of herpes-like DNA sequence in Kaposi's
sarcoma patients with and without HIV infection N. Eng. J. Med. 1995; 332;
1181-1185.
-
Moosa M.R., Treurnicht F.K., van Rensburg E.J. et al. Detection
and subtyping of human herpesvirus-8 in renal transplant patients before
and after remission of Kaposi's sarcoma Transplantation. 1998; 66; 2: 214-218.
-
Nickoloff B.J., Foreman K.E. Charting a new course through the chaos
of KS (Kaposi's sarcoma) Am. J. Pathol. 1996; 148; 1323-1329.
-
Penn I. Sarcomas in organ allograft recipients. Transplantation.
1995; 60; 12:1485-1491.
-
Penn I. Kaposi's sarcoma in transplant recipients. Transplantation.
1997; 64; 669-673.
-
Qunibi W., Akhtar M., Sheth K. et al. Kaposi's sarcoma: the most
common tumor after renal transplantation in Saudi Arabia Am. J. Med. 1988;
84; 225-232.
-
Szende B., Tґoth A., Perner F., Nagy K., Takґacs K. Clinicopathologic
aspects of 8 Kaposi's sarcomas among 1009 renal transplant patients Gen-Diagn-Pathol.
1997; 143; 4: 209-213.
-
Tur E., Brenner S. Treatment of Kaposi's sarcoma Arch. Dermatol.
1996; 132; 327-331.
-
Weiss S.W. Histological Typing of Soft Tissue Tumors. 2-d Ed. Springer,
1994.
|
